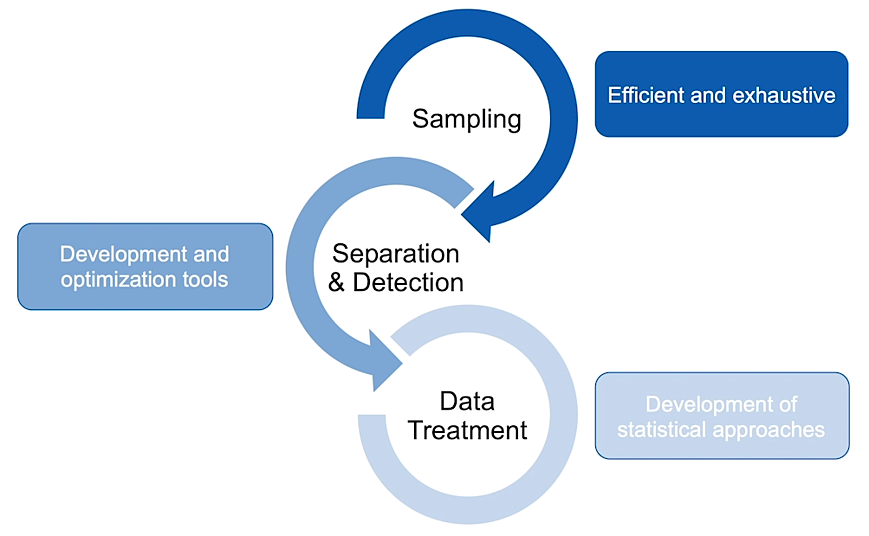
Pour chaque projet clinique des études de groupe de Jef, le projet comporte trois « piliers ». Tout d’abord, des échantillons doivent être obtenus. Ensuite, ils doivent être introduits dans un spectromètre de masse pour la séparation et la détection. Enfin, les données obtenues doivent être traitées de manière appropriée pour produire des résultats utiles et intelligibles. Alors que le traitement des données était le plus petit des piliers, les progrès de la technologie de LECO ont produit une grande quantité de données, et il est devenu essentiel de les découper en couches plus minces et plus faciles à traiter.
« Parce que, si nous allons à l’hôpital et parlons avec nos collègues, ceux-ci se fichent vraiment que je leur dise “La période de modulation était de 4 secondes, la vitesse d’acquisition était de 250 hertz...”. Ils répondront “Oui, oui”, par politesse, mais ils s’en fichent royalement. Ils veulent juste savoir : est-ce un échantillon positif ou négatif ? »
Lorsqu’il s’agit de soins aux patients, minimiser les faux négatifs et les faux positifs est crucial pour fournir le traitement approprié. Chacun des trois piliers joue un rôle essentiel dans ce processus.
Tous les résultats commencent par l’acquisition d’un échantillon. Il existe plusieurs façons d’obtenir un échantillon d’un patient asthmatique, mais beaucoup sont considérées comme des procédures « invasives », telles que la collecte de sang ou d’expectorations, le lavage bronchoalvéolaire, les brossages bronchiques et les biopsies de la paroi bronchique. En revanche, la collecte des condensats respiratoires dans un sac Tedlar® est une méthode relativement rapide et indolore pour obtenir un échantillon du patient. Il est également facile d’expliquer à un patient : Voici un sac, veuillez soufflez dedans.
Une fois qu’un échantillon est obtenu et amené au laboratoire, le Pegasus de LECO® BT 4D peut séparer et détecter les centaines de milliers de composés dans l’échantillon. C’est là que beaucoup de gens se trompent, dit Jef.
« Vous devez être sûr de pouvoir utiliser de bonnes données. Encore une fois, c’est un inconvénient du GC×GC et du spectromètre de masse à temps de vol (TOFMS) : les instruments sont si bons que vous pouvez finir par avoir une faible efficacité de modulation, une mauvaise forme de crête, et le système vous donnera quand même quelques informations. Mais il sera plus difficile pour le système de vous fournir de bonnes informations. Donc, il est toujours important d’avoir une bonne forme de pic, une bonne intensité de pic, et une bonne séparation. »
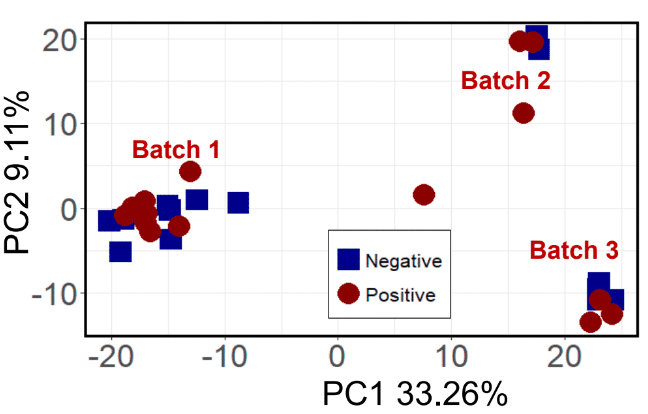
Une fois les données traitées, des traitements statistiques peuvent être appliqués. Avant de tester les patients asthmatiques, le groupe de Jef a d’abord effectué quelques expériences en utilisant un groupe test de patients atteints de cancer du poumon et un groupe témoin. Ils voulaient d’abord déterminer s’il était même possible d’utiliser des condensats respiratoires pour évaluer la santé du patient. Les premiers traitements de données ont entraîné une certaine séparation entre les groupes, mais ils ont abouti à trois groupes distincts au lieu de deux. Ils ont pu déterminer que les COV environnementaux avaient effectivement été détectés parmi des COV cancéreux, et les trois groupes correspondaient en fait aux trois périodes différentes de l’année où les échantillons ont été prélevés. Bien que fascinant, ce n’était pas le résultat escompté.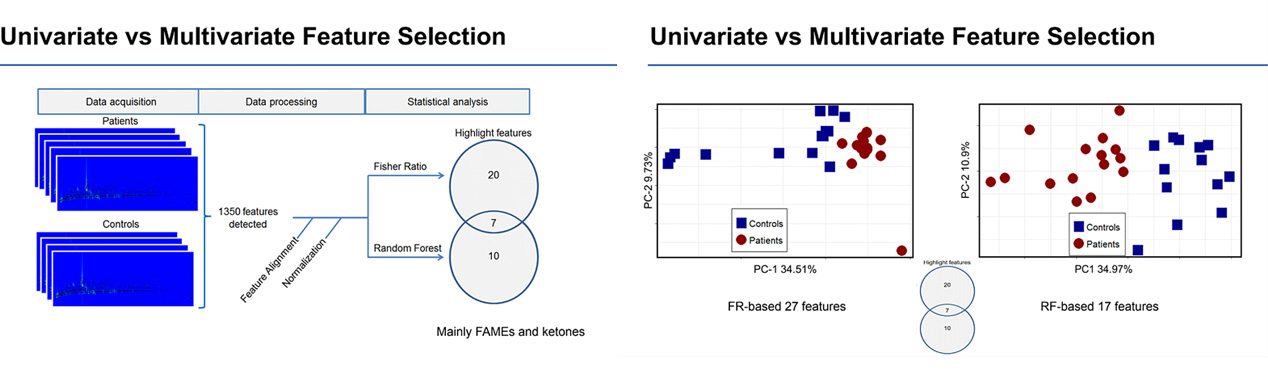
À l’aide de diverses méthodes de classification, Jef a pu réduire les 1350 caractéristiques détectées en deux ensembles : 27 avec Fisher Ratio et 17 avec Random Forest, dont 7 se chevauchent. De là, il a pu séparer les échantillons en deux groupes distincts, ceux positifs pour le cancer du poumon et ceux négatifs pour le cancer du poumon.
En soumettant les échantillons au Pegasus® GC-HRT 4D haute résolution, Jef a pu explorer les composés utilisés comme marqueurs.
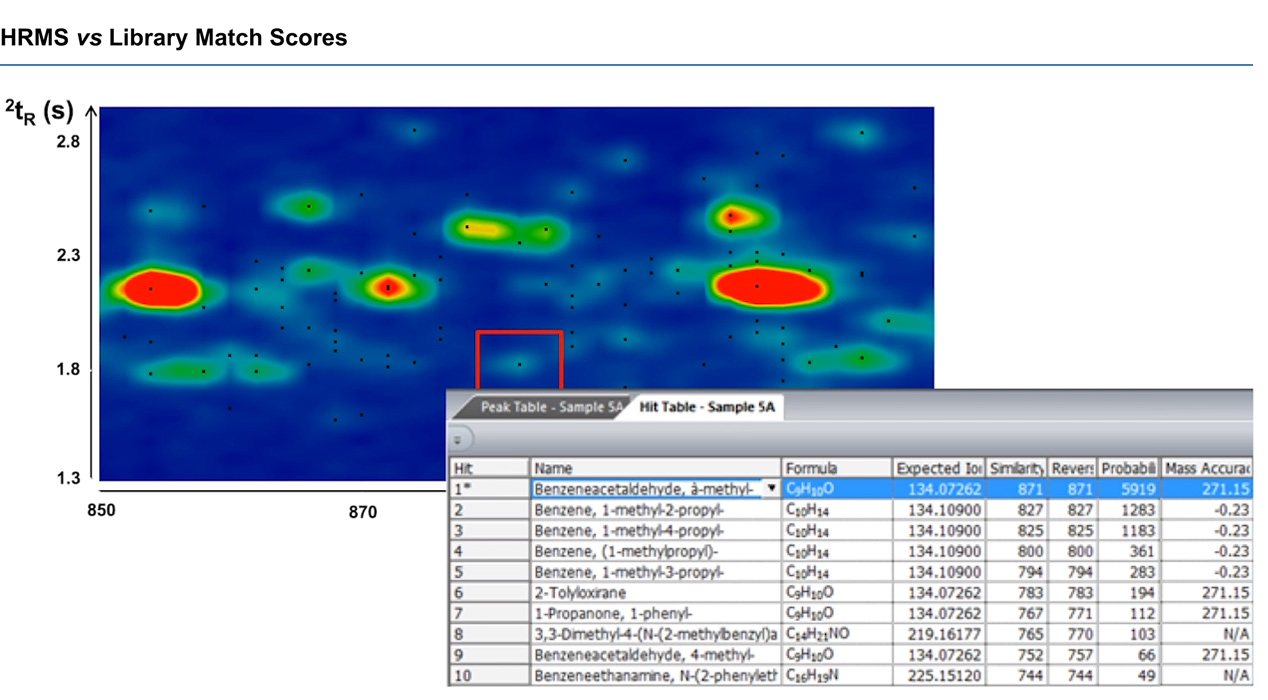
Comme vu ci-dessus, le pic marqué semble initialement être du benzèneacétaldéhyde, avec un score de correspondance de bibliothèque de 871. Cependant, la spécification de masse à haute résolution a permis à Jef de voir que la précision de masse était incroyablement médiocre de 271,15 ppm, tandis que le résultat probable suivant, le benzène, avec une similitude de 827, avait une bien meilleure précision de masse de -0,23 ppm. En utilisant les deux instruments en tandem, Jef a pu obtenir de meilleures informations sur les produits chimiques à partir de ses données.
Ces expériences ont accompagné l’étude de Jef sur l’empreinte respiratoire de l’asthme. Avec une augmentation des cas de 200 % au cours des dix dernières années, l’asthme touche plus de 334 millions de personnes dans le monde et 14 % des enfants de moins de 18 ans. C’est un problème croissant, et pourtant 20 % des patients asthmatiques se voient prescrire le mauvais médicament.
Il existe deux principaux phénotypes pour l’asthme : neutrophile et éosinophile. L’asthme neutrophile est davantage déclenché par les polluants et les infections, et peut être traité par des antibiotiques, tandis que l’asthme éosinophile est déclenché par des allergènes et peut être traité par des corticostéroïdes. Les corticostéroïdes sont inefficaces pour l’asthme neutrophile, et les antibiotiques sont sans effet pour l’asthme éosinophile.
Comme indiqué précédemment, de nombreuses méthodes de diagnostic de l’asthme sont invasives et présentent un taux de précision de 67 à 72 %. Le groupe de Jef a relevé le défi de prendre des condensats respiratoires de patients asthmatiques pour voir si le GC×GC-TOFMS pourrait proposer un diagnostic plus viable. Pour connaître ses résultats, consultez ici l’intégralité de l’enregistrement de son petit-déjeuner-séminaire à l’ASMS de cette année.
* Ce produit n’est pas destiné à diagnostiquer, traiter, guérir ou prévenir une maladie.